кислород Получаване 1
В този раздел е:
> Откриване на кислород;
> От кислород получаване в индустрията и лаборатории;
> Реакция на разлагане.
Кислородът е открит през втората половина на ХVIII век. няколко учени от различни страни. На първо място, този газ е шведски химик K.-V. Шееле през 1772 г. и две години по-късно, без да знае на опита на предшествениците - британски химик J. Пристли .. През 1775 френският учен А. Лавоазие учи кислород и му даде името на кислород.
Кислородът може да се открие чрез тлеене раздробят. Splinter поставя в съда с газа. светли вълни (фиг. 53).

Фиг. 53. Откриване на кислород: и - раздробят тлеещ във въздуха; б - пожар отцепила кислород
Получаване на кислород в индустрията.
Неизчерпаем източник на кислород yavlyatsya въздух. За да се получи от него кислород, този газ трябва да бъде отделен от азот и други газове. На тази идея е индустриален метод за производство на кислород. го изпълни с помощта на специална, доста обемиста екипировка. На първо място, въздухът се охлажда, за да го превърне в течност. След това, температурата на втечнен въздух се увеличава постепенно. Първият от него започва да се отдели азотен газ (температурата на течния азот кипене на -196 ° С) и течността, обогатен с (точка на кипене кислород -183 ° С) кислород.

Фиг. 54. Получаване на кислород чрез нагряване на живак (II) оксид
Първи кислород в лабораторията. Лабораторни методи за получаване на кислород се основават на химични реакции.
. J. Priestley получаване на газ от съединение, чието име - живак (II) оксид. Учените са използвали стъклени лещи, чрез който се фокусира върху същността на слънчева светлина.
В съвременните версии на този експеримент е показан на Фигура 54. При нагряване, живак (||) оксид (жълт прах) се превръща в живак и кислород. Освободен живак в газообразно състояние и се кондензира върху стените на тръбите под формата на сребърни капки. Кислородът се събира над водата във втората тръба.
Сега метод Priestley не се използва, тъй като живачни пари са токсични. Кислород, произведени от други реакции, подобни разглеждат. Те са склонни да се случи, когато се нагрява.
Реакциите, при които се образуват едно от няколко други вещества, наречени реакции на разпадане.
За лабораторна употреба кислород в такива съединения oksigensoderzhaschie:
• калиев перманганат KMnO4 (калиев перманганат име домакинство; вещество е общ дезинфектант)
• Калиев хлорат KClO3 (родово име - bertoletova сол, след френския химик късно XVIII -. НАСЛЕДСТВО началото на XIX век Бертоле)
Малко количество катализатор - манган (ГУ) оксид МпО 2 - се прибавя калиев хлорат за разлагане на съединението се наблюдава с отделяне на кислород 1.
Лабораторни експеримент номер 8
Получаване кислород разлагане Водороден пероксид Н 2О 2
Излива се в флакон 2 мл разтвор на водороден пероксид (традиционно наименование на вещество - водороден пероксид). Light дълго раздробят и да го изплати (както и с един мач), че тя едва тлеещ.
Излива се в един флакон с разтвор на водороден малко катализатор оксид - черен прах манган (ГУ) оксид. Гледайте отделяне на газ. Използването на тлеещ отцепила се уверите, че газ - кислород.
Направи уравнение Водороден пероксид реакция разлагане, който реакционен продукт е вода.
В лабораторията, кислород могат да бъдат получени чрез разлагане на натриев нитрат или калиев нитрат NaNO3 KNO3 2. Съединения първо се стопява чрез загряване, след това се разширява:
1 Когато отопление става без катализатор съединение различен реакция
Тези две вещества се използват като торове. Общата им име - нитрат.
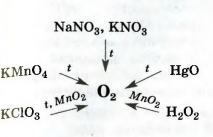
Схема 7. лабораторни методи за производство на кислород
► Transform реакции съединение в химически уравнения.
Информация за това как да се получи кислород в лабораторията, са събрани в Схема 7.
Кислород заедно с водород са продукти на разлагане на вода от електрически ток:
Естеството на кислород образува в резултат на фотосинтеза в зелени растения листа. Опростена схема на процеса е, както следва:
Кислородът е била открита в края на XVIII век. няколко учени.
Кислородът се произвежда търговски от въздуха, и лаборатории - чрез реакции на разпадане oksigensoderzhaschih някои съединения. По време на реакцията на разлагане на едно вещество, образувана от две или повече вещества.
129. Как да получите кислород в индустрията? Защо не се използва калиев перманганат или водороден пероксид?
130. Що за реакция е реакцията на разлагане?
131. Обърнете се към химични уравнения такава схема на реакция:
132. Какво е катализатор? Как може да повлияе реакциите на химията поток, Месечен? (Моля, използвайте като материал § 15.)
133. Фигура 55 показва точка разлагане на бяло твърдо вещество, което има формула Cd (NO3) 2. Разгледайте внимателно картината и опише всичко, което се случва по време на реакцията. Защо мига тлеещ подпалка? Направете подходящ химичен уравнението.
134. Масс фракция с кислород в остатъка след загряване KNO3 на калиев нитрат е 40%. Напълно разложен ако връзката?
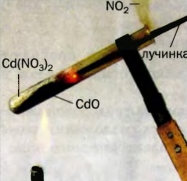
Фиг. 55. разлагане на веществото при нагряване
Ако имате корекции или предложения на този урок, моля свържете се с нас.
Ако искате да видите и другите корекции и предложения за уроци, погледнете тук - Образователен форум.