Метали и техните съединения
Реакция уравнения за метали:
- а) прости вещества: кислород, водород, сяра, азот, въглерод;
- б) до сложни вещества: вода, киселини, основи, соли.
- K S-метали включват елементи от групи I и II, всички елементи на а-и р-елементи от Група III (с изключение на бор), както и калай и олово (IV група), бисмут (V лента) и полоний (VI група). Метали най-вече са на енергия на нивото на външния електрон 1-3. Атомите г-елементи в рамките на периода от ляво на дясно се пълни г-поднива predvneshnego слой.
- Химичните свойства на метали поради характерното структурата на техните външни електронни черупки.
В рамките на периода от увеличаване на основните радиуси такса атоми с един и същ номер на електронен слой се намалява. Най-големи радиуси са алкални метални атоми. По-малкият атомен радиус, по-голям енергията на йонизация и колкото по-голяма атомен радиус е по-малка енергия йонизация. Тъй като металните атоми са най-големите радиуси атоми, те се характеризират предимно ниски стойности на енергията йонизация и електрон афинитет. Безплатни метали проявяват изключително редуциращи свойства.
3) метали образуват оксиди, например:

Той реагира с водород само алкални и алкалоземни метали, които хидриди:

Метали реагират с халогени, които халогениди със сяра - сулфиди, азотни - нитриди, въглерод - карбид.


С увеличаването на алгебрични стойностите на стандартния електрод потенциал E 0 на метала в електрохимичната серия от метал да реагира с вода се намалява. Така, желязото реагира с вода само при много висока температура:

Метали с положителен стандарт потенциал електрод, т.е. заставане след водород в електрохимична серия, не реагират с вода.
Характеризира се с метали реакция с киселини. Метали с отрицателна стойност Е 0 изместват водород от разтвори на солна киселина, Н 2 S0 4. H 3 P0 4 и други подобни. D.

Металът с долната E0 измества метал с голяма стойност на Е 0 на солеви разтвори:
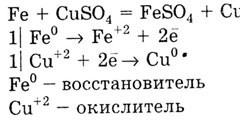
Критичен калциев съединението, получено в промишлеността, техните химични свойства и методи на получаване.
а) реагира с вода за освобождаване на големи количества топлина:
СаО + H 2 0 = Са (ОН) 2 (хидратна вар).
б) взаимодейства с киселина, за да се образува сол и вода;
СаО + 2Н + = Са2 + + Н 2О
в) взаимодейства с киселинен оксид да образуват соли:
Калциев хидроксид Са (ОН) 2, се използва във формата на негасена вар, вар мляко и вар вода.
Варно мляко - суспензия се образува чрез смесване на излишък на гасена вар с вода.
Лайм Вода - бистър разтвор, получен чрез филтриране на варно мляко. Използваните в лабораторията за откриване на въглероден оксид (IV).
Са (ОН) 2 + СО 2 = СаСОз 3 + Н 2О
Удължено преминаване на въглероден окис (IV) pastvor става прозрачен, като образува сол киселина във вода:
Ако полученият бистър разтвор на калциев бикарбонат се нагрява отново помътняване се случва, защото падане SaS0 3 утайка.