Моларен маса азот (N), и примери с формула
Съотношението на масата (т) вещество си брой (п) се нарича моларна маса вещества.
Моларното маса обикновено се изразява в г / мол, поне в кг / Kmol. Тъй като един мол от всяко вещество съдържа същия брой единици, моларната маса на веществото е пропорционален на масата на съответните структурни звена, т.е. относителната атомна маса на веществото (н):
където κ - фактор на пропорционалност е еднаква за всички вещества. Относително молекулно тегло - безразмерна величина. Тя се изчислява относителната атомните маси на химични елементи в периодичната система DI Менделеев.
Относителната атомната маса равна на атомен азот 14,0067 САМ Неговата относителна молекулна маса е равна на 14,0064 и молекулна маса:
М (N) = н (N) х 1 мол = 14,0067 г / мол.
Известно е, че азот двуатомен молекула - N2. След това, относителната атомна маса на азот молекула е равен на:
Аг (N2) = 14,0067 х 2 = 28.0134 атомни масови единици
Относителна молекулна маса от азот молекула е равна 28,0134 и молекулна маса:
М (N2) = н (N2) х 1 = 28.0134 мол г / мол, или само 28 грам / мол.
Азотът е безцветен газ, притежава нито миризма нито вкус (атомна структура схема, показана на фиг. 1), слабо разтворим във вода и други разтворители с много ниски температури на топене (-210 ° С) и точка на кипене (-195,8 о С).
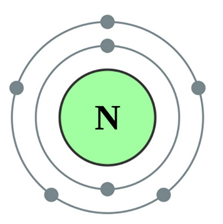
Фиг. 1. Структура на азотния атом.
Молекулното тегло на веществото в газообразно състояние може да се определи с помощта на концепцията на своята моларен обем. За да намерите този обем заети в нормални условия на определена маса на веществото, а след това се изчисли теглото на 22,4 литра на този материал при същите условия.
За постигането на тази цел (изчисляване на молекулна маса) може да използва закона за идеалния газ (Менделеев-Клапейрон уравнение):
където р - газ под налягане (Ра), V - обем на газ (m 3), m - маса на веществото (д), М - моларен маса от материал (г / мол) T - абсолютна температура (К), R - е универсална константа на газа равно на 8.314 J / (мол х К).
Примери за решаване на проблеми
Азот може да бъде получен чрез термично разлагане на амониев нитрит:
Определя които обем газ коригиран до стандартни условия, образувани от разлагането на амониев нитрит маса 16 грама.
Уравнението на реакцията:
Изчислява се количеството вещество амониев нитрит (моларна маса е равна на - 64,06 грама / мол):
Според реакция уравнение п на (NH4 NO2): N (N2) = 1: 1, т.е. п (NH4 NO2) = N (N2) = 0,25 мол. Ние изчисляваме обема на отделения азот:
V (N2) = 0,25 х 22,4 = 5,6l.